行业资讯 | 从辉瑞子公司频被FDA警告看全生命周期合规的重要性


2020年3月25日,美国FDA向辉瑞印度子公司Pfizer Healthcare India(即Hospira Healthcare India)发出警告信【1】,原因是无菌注射剂的无菌生产、检测以及数据完整性方面的严重质量缺陷。笔者发现,该公司早在2019年3月4日就因类似问题受到过FDA警告【2】,让人不禁要问,辉瑞这家印度子公司到底怎么了?
自2010年至截稿时间,辉瑞共接受FDA CDER对其药品质量保证体系进行的现场检查共106次,其中零缺陷(NAI)36次,自愿整改(VAI)59次,强制整改(OAI)11次,强制整改的比例约为10.4%,和10年间FDA CDER对我国药企现场检查中OAI的比例相似,见图1,似与辉瑞这样的国际制药巨头身份不符。
图1. 2010年至今,中国药企和辉瑞接受CDER检查结果汇总
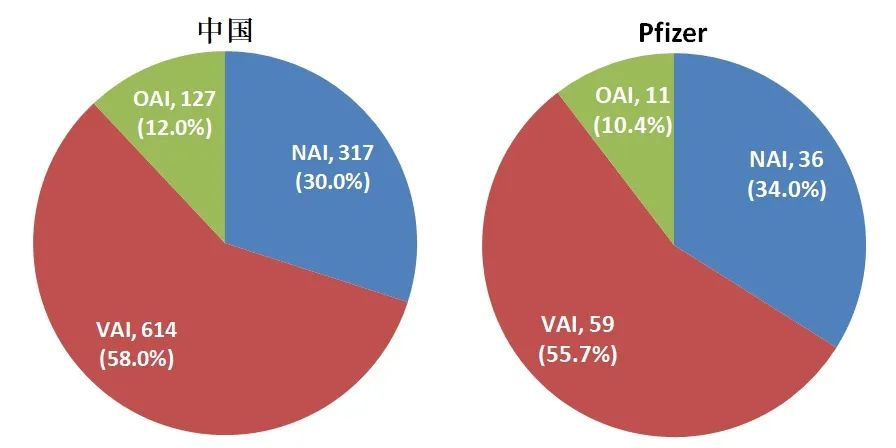
11次OAI中(见表1),有1次是2011年的Pfizer Pharmaceuticals,经整改在随后2013、2015、2016、2018和2019年的连续5次现场检查都以VAI结果通过;另10次分别是辉瑞在美国的子公司Meridian Medical Technologies(6次)和在印度的子公司Pfizer Healthcare India(4次)。经调查发现,这两家公司都是辉瑞并购的子公司。
表1. 11次OAI结果所涉及的辉瑞企业统计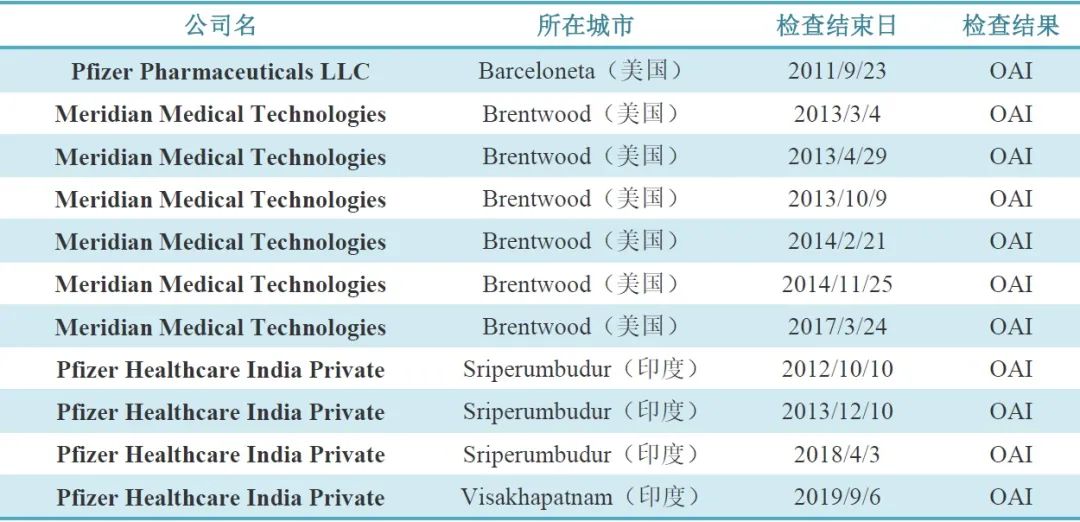
Meridian Medical Technologies于2009年被辉瑞收购,负责生产急救药EpiPen(肾上腺素自动注射产品),于2017年9月收到FDA警告信【3】,称该公司制造环节存在严重的违规情况,未能够彻底调查产品及成分与规定标准不符或差异情况;未建立充分书面规程,描述如何处理所有关于药品的书面和口头投诉并遵守;企业重复违规(2013年、2014年FDA频繁检查该企业结果都是OAI)证明企业对其产品的生产和监控不充分。
Hospira于2015年被辉瑞收购,其印度子公司改名为Pfizer Healthcare India,在印度有3家工厂,分别位于Aurangabad,Sriperumbudur和Visakhapatnam。其中,Aurangabad工厂最近一次检查是在2018年8月以VAI结果通过。Sriperumbudur工厂在2012、2013和2018年连续三次被警告,当前可能处于关闭状态。Visakhapatnam工厂近年接受过多次FDA检查,在2014年、2015年、2017年和2018年连续5次都以VAI结果通过,但2019年为OAI,并同时上了警告信。这次检查中,FDA检查员发现Visakhapatnam工厂未充分调查无菌检测不合格的根本原因,也没有有效实施CAPA来解决无菌检测缺陷,例如,虽然调查了批次某药品注射剂无菌检查失败原因(此批被拒),认为最可能是因为“缺乏某药品完整性测试”,同时还指出了可能的微生物污染来源。但是,Visakhapatnam工厂未做调整,CAPA实施的及时性不足。此外,Visakhapatnam工厂也没有充分调查微生物实验室条件和操作中的严重缺陷。FDA在警告信中强调已知Visakhapatnam工厂将于2020年7月启用自动化完整性测试,还聘请了一名顾问来审核操作并协助满足FDA的要求。但FDA强调应该尽快提供以下内容:
除印度工厂外,位于美国的Mcpherson的Hospira Inc,自2015年被辉瑞并购后,在2016和2018年两次现场检查中结果也都是OAI,被FDA警告。

专家观点

从辉瑞子公司案例可以看出,现场检查时发现生产和实验室检测过程中存在系统性问题后,想要快速完成整改的难度相当大,即使有辉瑞这样的制药巨头作为依托,辉瑞子公司的整改之路也并不顺利。然而,笔者发现,辉瑞在新加坡、加拿大、爱尔兰、比利时、意大利和德国等地的企业又表现良好。
从源头着手,事半功倍;道理易懂,但做到难。很多企业往往习惯于亡羊补牢,在事发之后才采取措施。现代化企业,牵一发而动全身,企业质量体系整改并不像扎紧羊圈栅栏那么简单,更何况丢羊之后才行动,就已经失了先机损失了羊。
笔者对辉瑞近10年迎检情况进行深度分析后发现,这些频繁的警告多发生在并购的子公司。在并购时,药企通常会对被并购企业的产品、财务进行全面尽调和评估,但对药品合规生产能力的评估可能未加以足够重视,结果将被并购企业在研发和生产上的缺陷一起并入。
史上最贵药物之一 ,制药巨头诺华的Zolgensma,也是并购过来的项目(来自其收购的美国企业AveXis),在获批上市仅两个月后,就因质量合规问题被FDA警告。
在全生命周期监管下,药企应将全生命周期合规性作为公司经营战略,除了研发和生产环节外,还应在项目立项、引进和并购时建立法规战略,识别法规风险,降低项目运营的不确定性。笔者建议,在并购项目和企业时,可以将研发和生产的合规性作为评估指标之一,同时在并购之后,持续关注药品的合规生产状况。
【1】
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/pfizer-healthcare-india-private-limited-594972-03252020
【2】
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/hospira-healthcare-india-pvt-ltd-557890-03042019
【3】
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/meridian-medical-technologies-inc-pfizer-company-525881-09052017

上海科志康医药科技有限公司,成立于2016年,是一家国内领先的药品法规咨询公司,专注于为制药企业提供高品质的注册申报、药物临床与临床前研究咨询服务,以及药物CMC、GCP、GLP和GMP/cGMP一站式第三方核查服务。








