专家观点 | 来了!CDE“突破性疗法”审批深度剖析

药品类型分析
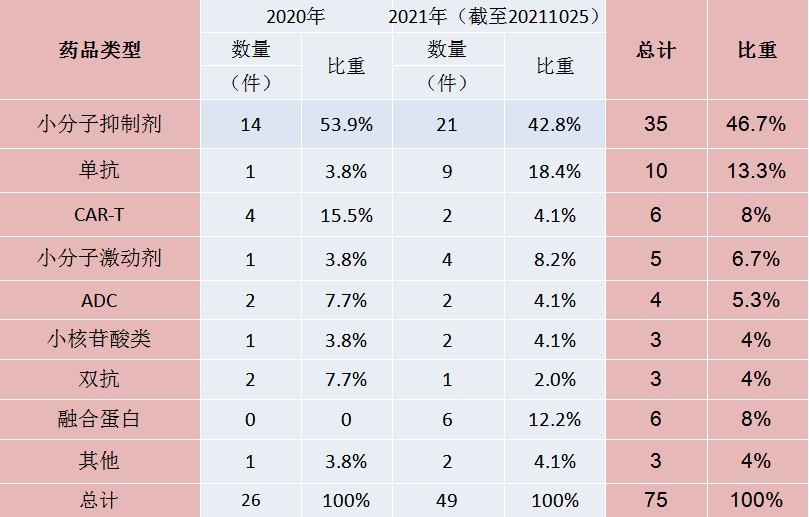
图1:CDE纳入突破性治疗药物类型
其中,获批的6项融合蛋白都是Bioverativ Therapeutics,Inc.、Biogen,Inc.和赛诺菲这三家公司共同合作开发的一款注射用重组人凝血因子VIII Fc-血管性血友病因子-XTEN融合蛋白,这是一款创新凝血因子VIII替代疗法BIVV001(rFVIIIFc-VWF-XTEN)。BIVV001拟定的适应症是用于患有A型血友病的成人和儿童:(1)常规预防治疗,用于减少出血的发生频率;(2)出血的按需治疗;(3)围手术期出血的处理。目前,患有严重血友病(血液不能正常凝固)的人通常每周须在家中注射凝血因子3到4次,以防止出血,而BIVV001可以将注射治疗次数减少到每周一次。患者只需每周接受BIVV001注射一次,便可在较长时间内维持较高水平的VIII因子活性,且安全性良好。该疗法已获得FDA和欧盟授予的孤儿药称号。
CAR-T疗法作为一种治疗肿瘤的新型精准靶向疗法,近几年通过优化改良在临床肿瘤治疗上取得很好的效果,是一种非常有前景的,能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。值得关注的是,2021年6月22日,NMPA官网公示显示,复星凯特的CAR-T细胞治疗产品阿基伦赛注射液已正式获批上市,这是一次阶段性的进展。这一产品的第二个适应症(用于治疗接受过二线或以上系统治疗后复发或难治性惰性非霍奇金淋巴瘤)已于2021年8月被CDE纳入突破性治疗药物程序。CAR-T细胞在治疗肿瘤方面非凡的潜力,还有待更多人来挖掘。
药品适应症分析
从药品相应的适应症上看,抗肿瘤药物数量优势显著,共39项,占比52%,是最热门赛道。血液相关疾病及抗病毒也是热门的关注焦点(见下图2)。
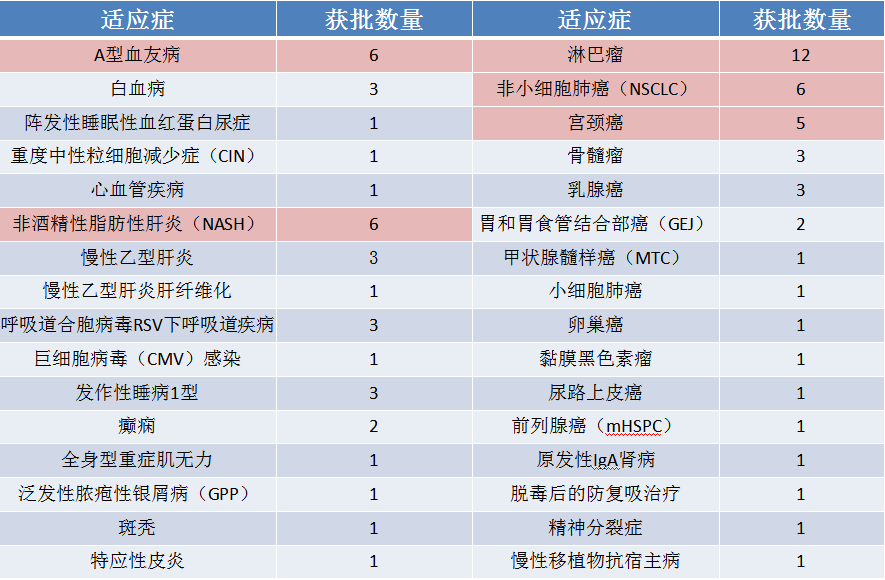
图2:CDE纳入突破性治疗药物适应症
万春的普那布林是一种鸟嘌呤核苷酸交换因子(GEF-H1)激活剂。值得注意的是,普那布林在先后两天内获得了中美两国的突破性疗法认定,这一产品将与粒细胞集落刺激因子(G-CSF)联用用于预防化疗对非髓性恶性肿瘤诱导的重度中性粒细胞减少症(CIN)。自1991年以来,只有G-CSF被批准用于预防重度CIN,普那布林有望借此加速上市成为30年来首个在重度CIN适应症治疗标准和临床获益上的突破性治疗药物。
药品靶点分析
从涉及靶点来看,EGFR、PD-1/L1、PI3K为热门研究靶点(见下图3)。这几个针对EGFR靶点的药物,其被“突破性疗法”获批的适应症都是用于治疗非小细胞肺癌。PI3K也作为实力靶点,为滤泡性淋巴瘤提供更好的治疗选择。
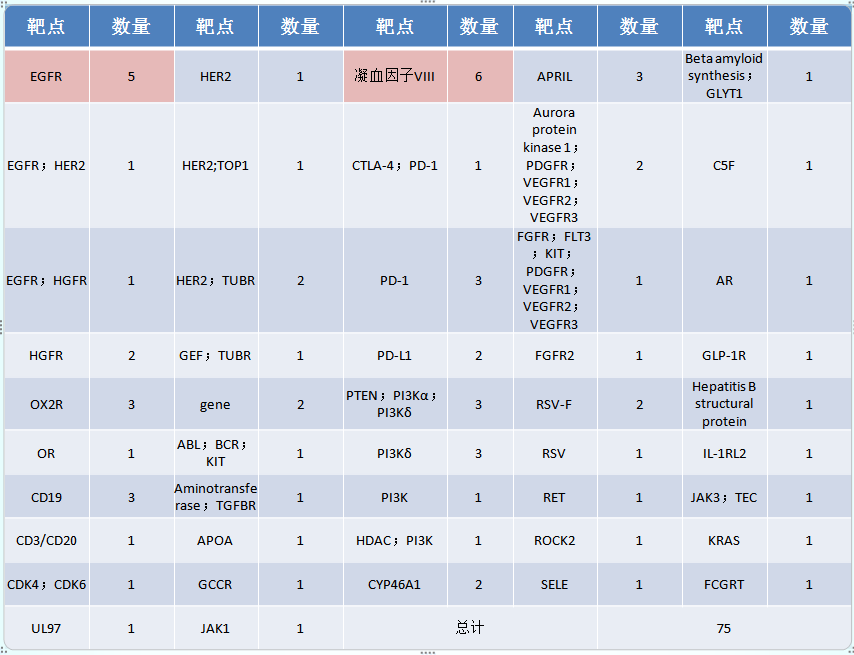
图3:CDE纳入突破性治疗药物靶点分析
其中针对KRAS基因的靶向药AMG 510已在2019年成为最火抗癌药。科学家们一度认为“KRAS是不可成药靶点,不可能有药物,放弃吧”,直到AMG 510的出现,才彻底打破这一“魔咒”。
AMG 510是安进(Amgen)公司研发的针对KRAS G12C突变的小分子抑制剂,其获得CDE“突破性疗法”的适应症为治疗既往接受过至少一种系统性治疗的携带KRAS p.G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。AMG 510已于2021年5月29日获得FDA批准,提前上市。毫无疑问,AMG 510具有里程碑意义,笔者相信AMG 510 会很快在中国获批上市,给KRAS突变患者带来希望。
药企分析
从药企占据量来看,知名外企占据最多,本土老牌药企也鼓足干劲。武田占据7项、赛诺菲占据6项、恒瑞及迪哲(江苏)医药各占据4项,成最大四位赢家(见下图4)。
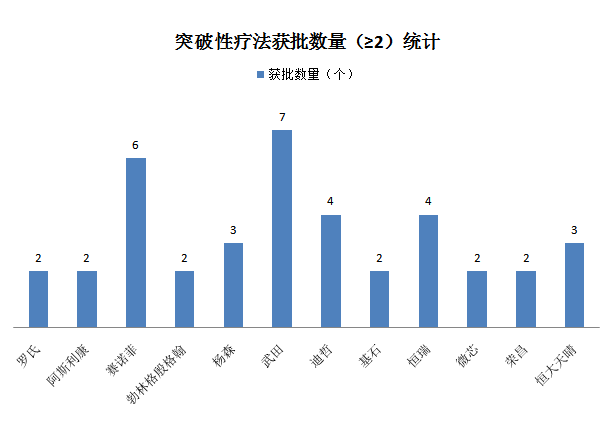
图4:CDE纳入突破性治疗药物药企分析
武田的 TAK-994是一款在研口服食欲肽-2受体(OX2R)激动剂,旨在选择性靶向食欲肽2受体,用于治疗发作性睡病1型。如果获得上市批准,TAK-994将成为首个治疗食欲素缺乏症的药物。但据CDE临床试验登记平台公示显示,由于TAK-994全球研究出现一起肝脏安全性信号SUSAR事件(“肝功能检查(LFT)结果升高事件”),基于武田安全委员会对此事件的评估,以及从所有已完成和正在进行的研究中获取的非盲态安全性数据的总体评价,出于高度谨慎,武田已经决定停止向所有TAK-994研究中的受试者给药,并终止该Ⅱ期临床试验。
恒瑞获批的4款产品,分别是SHR3680片、SHR6390片、苹果酸法米替尼胶囊、注射用卡瑞利珠单抗,其中苹果酸法米替尼胶囊和注射用卡瑞利珠单抗获批的适应症相同,用于治疗经过一线级以上治疗失败的复发转移性宫颈癌。
微芯生物的西奥罗尼是一款有新颖机制的靶向三通路选择性激酶抑制剂,属于小分子抗肿瘤新药。其获批的拟定适应症包括铂难治或铂耐药复发卵巢癌和治疗经过2线系统化疗方案治疗后疾病进展或复发的小细胞肺癌。国内外暂无相同产品上市。
未来展望
虽然突破性疗法认定有助于药品走上“加速审批”的快车道,但优厚的资源倾斜也意味着CDE对突破性治疗药物的 筛选更加严格,这需要企业通过“真技术”干实事,实现临床疗效的“真突破”。
我们也期待有更多的治疗罕见病、肿瘤等药品能加速上市,进一步满足中国重大疾病的临床治疗需求,为无药可医或濒临危重的患者带来福音 。
历史文章:
END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家专业的药品研发咨询公司,致力于为客户解决药品生命周期的难点和痛点,减少和避免注册时发生“少做、漏做、重做、多做”。
公司专注于药品法规战略咨询,提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率;在研发过程中提供法规咨询和第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外30多个知名制药企业建立合作,成功取得了40多项IND/NDA/ANDA佳绩。







