专家观点 | 历年CDE“优先审评”审批汇总分析

为加快具有临床价值的新药和临床急需仿制药的研发上市,2017年底,药监局出台《关于鼓励药品创新实行优先审评审批的意见》。2020年7月,国家食品药品监管总局发布并实施《药品上市许可优先审评审批工作程序(试行)》(附件1),并将2017年出台政策废止,并对纳入优先审评审批的药品范围进行了详细说明。
根据最新规定,药品上市许可申请时,具有明显临床价值的药品可以申请适用优先审评审批程序。可分为以下6种情形:
1)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药。
2)符合儿童生理特征的儿童用药新品种、剂型和规格。
3)疾病预防、控制急需的疫苗和创新疫苗;
4)纳入突破性治疗药物程序的药品;
5)符合附条件批准的药品;
6)国家药品监督管理局规定其他优先审评审批的情形。
申请人应当在提出药品上市许可申请的同时,通过CDE网站提出优先审评审批申请,并提交相关支持性资料,CDE将在5日内进行审核。对纳入优先审评审批程序的药品上市许可申请,审评时限为130日,其中临床急需的境外已上市境内未上市的罕见病药品审评时限为70日。(如下图1为优先审评审批流程)
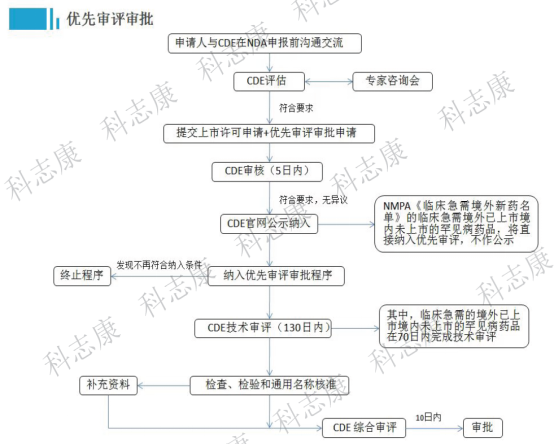
图1:优先审评审批流程图
政策实施以来,我国医药产品创新热度持续升温。截至2021年11月11日,被纳入优先审评的药品数量达到1307项(附件2,以受理号统计),涉及349家企业。这1307项药品中有5项已被终止程序。
根据笔者分析,从历年纳入优先审评的药品数量上来看,优先审评实施的前三年,每年被纳入优先审评的药品申请数量加快上升,其中2018年我国纳入优先审评的药品数量为345项,为近几年最高。但从2019年开始,纳入数量则明显逐年减少,预计2021年全年的数量将创历史新低。(如下图2)
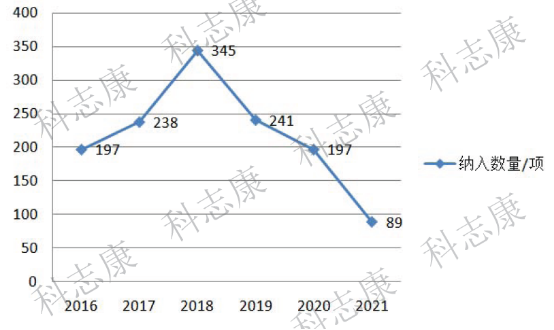
图2:2016年~2021年CDE纳入优先审评药品数量
从药企来看,优先审评品种数量≥15的企业如下图3所示。排名居前的企业大多为国内制药企业,恒瑞及东阳光高居榜首,都有42项被纳入。跨国企业诺华、拜耳等紧随其后。
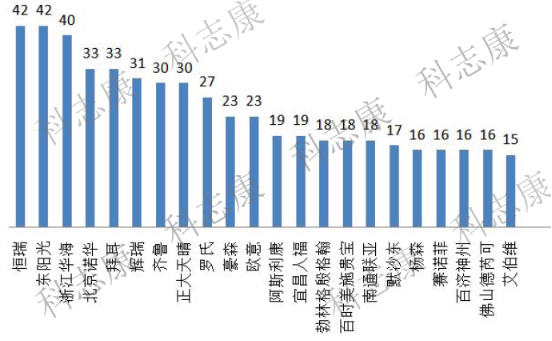
图3:优先审评品种数量≥15的药企
经过进一步分析,笔者发现,从2020年7月开始实施最新规定以来,有160项药品被纳入药品上市许可优先审评审批程序。这160项药品从申请优先审评到公示截止的平均审批耗时为28.2天(以自然日计算),最快审批耗时为2天,最慢审批耗时为150天。对于这160项药品,审评审批时限大大缩短,上市周期大幅度缩短,为企业带来更多的好处。
附件1:《药品上市许可优先审评审批工作程序(试行)》
附件2:《优先审评统计-更新至20211111》
如需下载附件,可点击阅读原文跳转至本司网页下载,谢谢!
历史文章:
最全“突破性疗法”CDE审批汇总
专家观点 | 来了!CDE“突破性疗法”审批深度剖析
专家观点 | 仿制药一致性评价获批最新汇总
END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家专业的药品研发咨询公司,致力于为客户解决药品生命周期的难点和痛点,减少和避免注册时发生“少做、漏做、重做、多做”。
公司专注于药品法规战略咨询,提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率;在研发过程中提供法规咨询和第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外30多个知名制药企业建立合作,成功取得了40多项IND/NDA/ANDA佳绩。







