被FDA和CDE纳入“突破疗法”和“优先审评”的普那布林能获批吗?

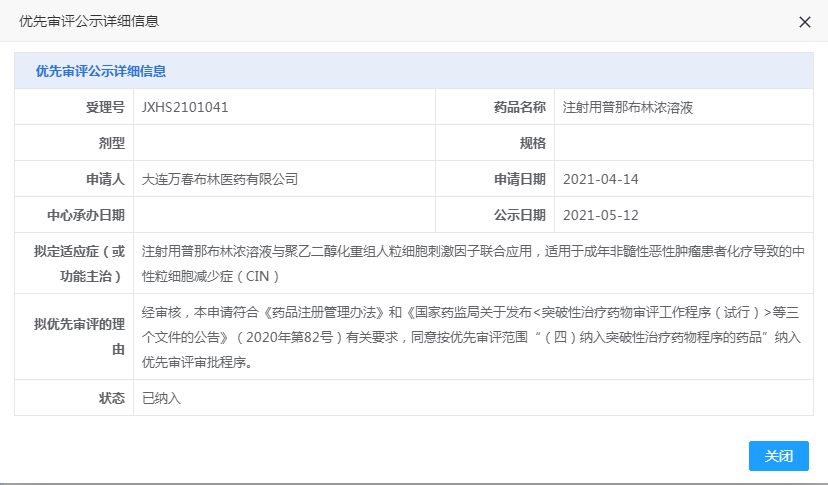
“普那布林(Plinabulin)”是万春医药(BeyondSpring Pharmaceuticals)的核心产品。2020年9月, 普那布林已先后获得中、美“突破性疗法”双重认定。2021年5月,普那布林的重度中性粒细胞减少症(CIN)适应症NDA申请也先后被中、美受理并授予“优先审评”认定。
普那布林是是一种选择性免疫调节微管结合剂(SIMBA),作用机理是能释放鸟嘌呤核苷酸交换因子GEF-H1,GEF-H1激活下游信号转导通路,进而激活c-Jun蛋白,而活化的c-Jun蛋白进入树突状细胞细胞核促进免疫相关基因的表达,引发树突状细胞成熟、T细胞活化以及减少中性粒细胞破坏以起到预防中性粒细胞减少症的疗效。
CDE网站公示显示,被纳入CDE“优先审评”认定的普那布林适应症为:其与粒细胞集落刺激因子(G-CSF)联用,适用于非髓性恶性肿瘤患者中骨髓抑制性抗癌药物引起的重度中性粒细胞减少症(CIN)。
中性粒细胞减少症临床未满足需求
中性粒细胞减少症(指外周血中性粒细胞绝对计数(ANC)低于2.0×109/L)是骨髓抑制性化疗药物引起的主要不良事件,是骨髓抑制性化疗最严重的血液学毒性。发热性中性粒细胞减少(febrile neutro penia,FN)是最主要的临床并发症,可能导致化疗药物剂量降低或治疗延迟从而降低临床疗效;也可出现严重感染等并发症,甚至死亡。
2015年美国临床肿瘤学会(ASCO)发布的《Recommendations for the Use of WBC Growth Factors: American Society of Clinical Oncology Clinical Practice Guideline Update》和《中国临床肿瘤学会(CSCO)肿瘤放化疗向相关中性粒细胞减少症规范化管理指南(2021)》都指出了G-CSF是目前预防或治疗化疗后引起的中性粒细胞减少症的有效药物。由于肿瘤类型与化疗方案的不同,以及患者自身条件的差异,该两个指南都建议对接受化疗的患者进行分层管理,合理使用 G-CSF以实现个体化预防与治疗FN的目的,如:
①对于接受高风险(FN的风险≥20%)化疗方案的患者,无论治疗目的是治愈、延长生存时间或是改善疾病相关症状,均建议预防性使用G-CSF。
②对于低风险(FN的风险<10%)的患者,不建议常规预防性使用G-CSF。
由此可见,不管是中国还是美国,使用 G-CSF一直是预防或治疗 CIN的标准护理,但其并非对所有患者都可用。而且G-CSF带有比较严重的副作用,其主要不良反应为轻中度骨痛,接受G-CSF的患者肌肉骨骼疼痛风险增加约4倍;G-CSF还可引起中性粒细胞一过性增高,引起中性粒细胞类白血病反应。另外,即使使用 G-CSF,超过 80% 的接受化疗的癌症患者仍可能出现 4 级中性粒细胞减少症,这可能导致严重感染、住院甚至死亡。因此,CIN 仍然代表着未满足的医疗需求。
值得注意的是,G-CSF 治疗的主要益处是在化疗后的第 2 周,化疗后第 1 周被认为是“neutropenia vulnerability gap”,超过 75% 的 CIN 相关临床并发症会在化疗后第1周发生,包括FN、感染、住院和死亡。普那布林是第一个有可能填补这一空白的药物,它有可能在 G-CSF 有效之前的化疗治疗的关键第1周发挥作用,以预防 CIN 的发生和改善临床结果。正如 PROTECTIVE-2 3 期注册研究所示,普那布林和 G-CSF 的结合可以最大限度地保护患者的整个化疗周期。
根据普那布林的国际多中心III期临床试验PROTECTIVE-2研究公布的结果显示,在CIN的预防方面,普那布林与培非格司亭(G-CSF)的联合治疗显著优于当前的培非格司亭(G-CSF)单药标准治疗,该项关键临床研究在主要和所有关键次要终点方面均都达到优效性。与单药治疗相比,联合治疗不仅没有增加额外的毒性,反而将4级安全性事件发生率降低了许多,真正起到了增效减毒的作用。在耐受性方面,联合治疗整体耐受性良好,在骨痛、血小板减少和生活质量等多个方面显示出有临床意义的改善的趋势。
普那布林在作用机制及激活免疫方面的独特性,给CIN的治疗带来了疗效及安全性的突破。笔者相信此具有“突破性”的CIN治疗药物,还可将通过与化疗和/或肿瘤免疫治疗联合应用带来更大的突破,并获得下一个“优先审评”,加快上市。
普那布林近期研发进展
2021年8月25日,恒瑞医药与万春医药子公司大连万春签署《增资入股协议》和《普那布林产品合作协议》,恒瑞医药拟以自筹资金入股大连万春,并获得在大中华地区的联合开发及独家商业化普那布林的权益。
但2021年12月1日晚间,万春医药发布公告称,普那布林治疗化疗引起中性粒细胞减少症(CIN)的上市申请收到美国FDA的完全回复函(CRL)。该回复函表明,仅一个注册临床研究(106 Phase 3,研究106的III期临床试验,NCT03294577)的数据不足以充分证实普那布林的临床价值,还需要第二个对照注册临床研究来提供支持预防化疗引起的CIN适应症的实质性证据。基于目前的数据,FDA无法批准该项NDA。万春医药公司市值受重挫高达60%。恒瑞在公告中指出,关于产品后续研发计划以及合作事项,双方近期将进一步协商。
此次FDA的NDA搁浅,有专家猜测可能是因为人种差异问题,研究106的II期和III期临床试验均没有美国患者参与,两项试验的患者来自中国和乌克兰。样本数量是够的,但是样本多样性存在问题。
此外,FDA通常需要两个关键的有效研究才能批准一种药物。FDA通常不认为单个临床试验足以作为关键试验,除非它能证明对死亡率、不可逆发病率或预防具有潜在严重后果的疾病具有临床意义的影响,并得到良好控制。不过,目前普那布林仅一个注册临床研究106的III期临床试验的结果不足以让FDA批准其上市。
2022年1月11日,万春医药宣布了一项组织精简计划,将其美国员工减少35%,包括将某些人员重新分配到子公司,预计这将节省成本,从而扩大现金渠道。
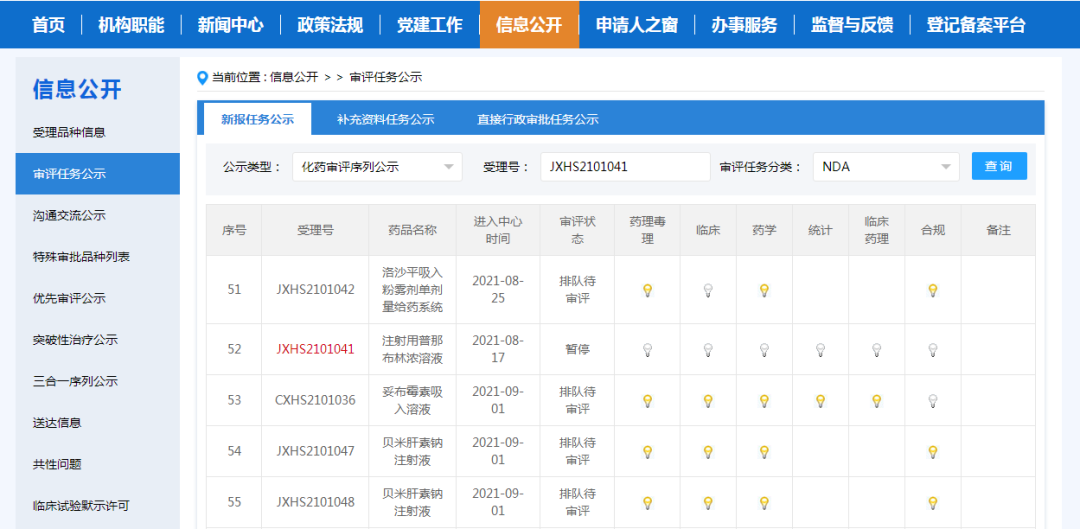
目前,CDE官网上显示用于CIN适应症的NDA申请已于2021年8月正式获得CDE受理,该品种各学科专业已完成审评,但其审评状态为暂停。展望未来,万春医药打算优先考虑以下临床和监管活动:
-
继续推进中美两国普那布林在CIN中的进程
-
美国和中国非小细胞肺癌(NSCLC)的 NDA 备案和监管流程
-
普那布林在多种癌症三联联合 IO 治疗中的免疫肿瘤学 (IO) 试验进展。
END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家以药品监管科学为特色的研发咨询公司,致力于为客户定制法规解决方案,减少和避免在注册申报时“少做、漏做、重做、多做”的风险。
在药品注册时,公司提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率。在研发过程中,公司提供第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外30多个知名制药企业建立合作,成功取得了40多项IND/NDA/ANDA佳绩。
公司使命:为制药企业提供专家解决方案,提升药品全生命周期合规性
公司愿景:助力制药企业研发和生产,让老百姓吃上放心药







