原料药生产车间483案列更新—Rentschler Biophanma

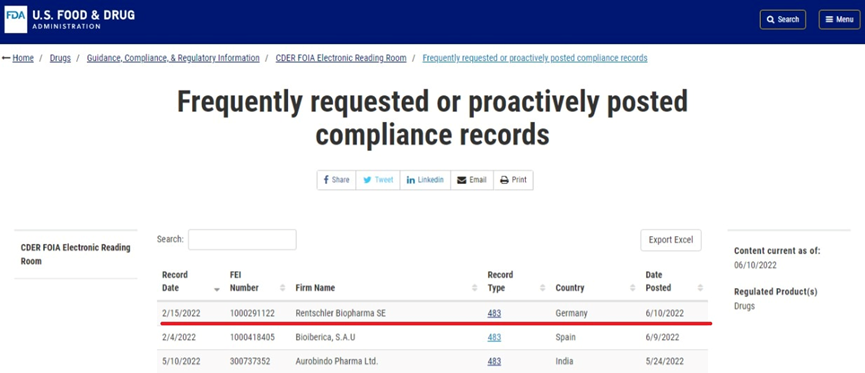
原料药通过(b)(4) 灌装配送时,没有泵的RPM规格,也没有RPM设置的文件记录。
观察二
组件清洁后待用,顶部下方有变色环。变色的根本原因未说明,没有正式的风险评估或纠正措施来解决变色问题。
观察三
没有确保符合既定规范和标准的实验室程序或测试。具体来说:
(1)标准操作程序文件编号:RL-TP-00048,检查细菌内毒素:动态比浊法检测/静息细菌内毒素:动态比浊法检测,Rev14描述了原料药过程控制和释放检测的整体设施方法,但没有看到根据验证进行内毒素检测的时间限制。(2)将原料药过滤到袋系统中,在此系统中采集释放稳定性样本。释放的稳定性样本不代表最终的原料药容器封闭系统。
观察四
药物赋形剂(辅料)未得到充分控制。具体来说:
没有对主要原料药溶液或稀释剂的潜在问题进行风险评估或分析评估。
观察五
支持生产的设备和设施系统尚未得到充分验证。具体来说:
(1)用于接种培养的七个培养箱没有室分布曲线评估,所有单元没有渗透曲线以确保符合规范。(2)生产系统可一直保持消毒状态,直至待生产,无需保持石灰验证以确保保持消毒状态。(3)没有对最坏情况下的负载进行常规的物理和生物再鉴定,以确保维持验证状态。(4)将储槽清洗干净,并过滤到容器中并保持最长(约)(b)(4)小时。从微生物控制的角度来看,没有支持保留时间的验证,也没有描述批生产的保留时间限制或文件强制实践的程序。但在SAP(材料管理系统)中表示,已为储罐维护设置了有效期。(5)观察符合(b)(4) C°储存条件的区域,而这些区域没有经过温度条件的验证。(6)根据清洁验证概念,至少要执行3次成功的清洁验证运行才能达到验证状态。但该企业的清洁验证不符合预先批准的可接受标准。
观察六
被拒绝的材料并不总是在SAP系统中按照隔离/搁置分类进行控制,以防止其被未经授权的使用。具体来说:
启动了可比性研究方案# STAB-I02777,以评估该批次是否在统计学上与仅进行过滤的先前生产批次相似。在此评估期间,从未在SAP系统中锁定(例如,搁置或隔离)孵化室。方案STAB-102777确认批次与历史批次不可比,批次被拒绝。
观察七
未能建立适当的系统来监控关键工艺设备的环境条件。具体来说:
位于GMP仓库内可用于原料药储存的大约12台(b)(4)超冷冷冻机处于局部警报状态。没有确认本地警报条件或评估警报对设备合格状态的影响的程序要求。未保持冷冻机的合格状态。
观察八
支持生产的设施和设备没有得到充分的维护。具体来说:
(1)在建筑物内观察到的是水系统,观察到的建筑面积处于恶化状态。(2)在10号装运和接收大楼内观察到一个通往外部的装卸(b)(4)台门,门密封不充分,地板和门之间有大约1/4英寸的间隙。(3)GMP仓库墙壁和原料/中间体储存架之间的区域没有保持清洁。观察到该区域很脏,堆积了灰尘和纸张,包括一个用于储存原材料的容器和一个装有过滤器的棕色纸箱。此外,发现仓库和托盘清洗区前面的排水管和格栅很脏,包括材料残留物。(4)程序RL-SOP-00368,标题为材料使用指南;修订版8描述了移动设备(例如,容器、集装箱等)带入卫生区和卫生区,带孔材料不得有明显损坏。然而,在对生产区域进行检查时,发现GP套件前面有一个生锈的集装箱底盘。没有程序规定/描述受损/变质集装箱底盘的维护流程。
观察九
没有遵循支持生产的程序控制。具体来说:
(1)对LIMS系统(实验室信息管理系统)中的保留样本的流动/转移进行了评估,在LIMS描述的储存地点未发现样本。(2)根据SOP文件,编号:RL-SOP-00830,在“处理偏差的时间表”中指出,从发现偏差之日到完成偏差之日的几天处理期内,应处理轻微偏差报告。如果偏差不能在规定的处理期内完成,应在检测到延迟后编写一份中期报告(由偏差报告触发的延期请求)。在对需要延期的十一个偏差的审查中,只有三个偏差准备了延期。
如需查看原文,可点击文章左下角“阅读原文”进入。
历史文章:
FDA警告信:工艺验证、清洁验证不充分,质量管理体系存在漏洞
行业资讯 | Aurobindo最新收到2封警告信解析以及回顾FDA对其现场检查史
行业资讯 | 一年内收到两封警告信?美国仿制药厂KVK-Tech的合规问题
END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家以药品监管科学为特色的研发咨询公司,致力于为客户定制法规解决方案,减少和避免在注册申报时“少做、漏做、重做、多做”的风险。
在药品注册时,公司提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率。在研发过程中,公司提供第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外79个知名制药企业建立合作,取得了100多项IND/NDA/ANDA佳绩。
公司使命:为制药企业提供专家解决方案,提升药品全生命周期合规性
公司愿景:助力制药企业研发和生产,让老百姓吃上放心药







