突破性治疗认定为什么会被撤销?FDA新指南草案给出说明

由于获突破性治疗认定(BTD)的产品可以得到FDA的资源倾斜,例如自Ⅰ期临床试验开始强化对有效率的药品研发计划的指导等,因此更多药企加大对有潜力获BTD的药物的研发。
目前,BTD由FDA的CDER与 CBER这两大机构进行评定。笔者分析了这两大机构的BTD相关数据,截止到2021年9月30日,FDA共收到1191件BTD申请,其中授予471件,拒绝572件,撤回136件,另外12件正在审核过程中。这些药物涵盖小分子化学药、抗体、蛋白类、反义寡核苷酸类等。它们治疗多种疾病,尤其是癌症、丙型肝炎和囊性纤维化。如下图,在BTD的审批上,CDER的批准率约为40%,CBER的批准率为32%,整体4成左右的的通过率说明FDA对于BTD的审批还是比较谨慎的。
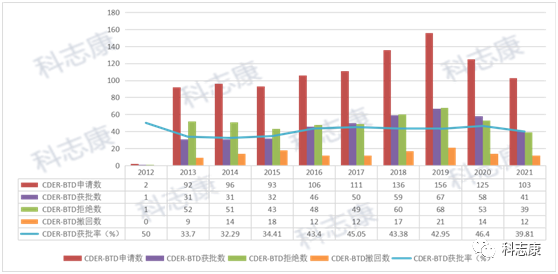 CDER的数据汇总
CDER的数据汇总
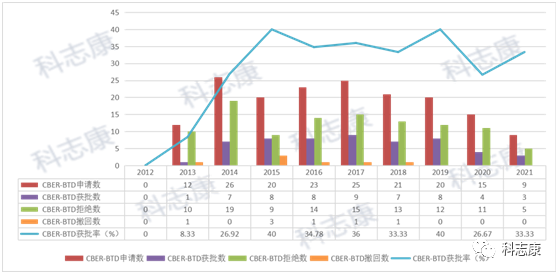
CBER的数据汇总
或许是因此原因,2022年6月23日,FDA颁布了《行业指南:撤销突破性治疗认定的注意事项》 草案,该指南介绍了在评估药物开发进程时,FDA撤销BTD的一般考虑因素,值得药企去考量,下面对其进行翻译:
一、导言
本指南解释了在评估药物开发计划期间,FDA可能考虑是否撤销突破性治疗认定(BTD)。该指南是与行业指南:Expedited Programs for Serious Conditions––Drugs and Biologics (May 2014)以及药物评价和研究中心(CDER)和生物制品评价和研究中心(CBER)的其他 BTD 政策和程序中包含的有关 BTD 的信息保持一致,并对其进行了补充。
本文件的内容不具有法律效力,且也不意味着以任何方式约束公众,除非特别纳入合同。本指南是仅旨在向公众澄清法律规定的现有要求。包括本指南在内的FDA指导文件应仅视为建议,除非引用了特定的法规或法定要求。在FDA指南中使用“应该”一词意味着建议或推荐某事,但不是必需的。
二、背景
《联邦食品、药物和化妆品法案》(FD&C法案)第506(a)条(《美国法典》第21篇第356(a)条),规定给予BTD "如果该药物拟单独或与1种或多种其他药物联合使用,用于治疗严重或危及生命的疾病而且有初步临床证据表明该药物可能在1个或多个具有临床意义的终点上的显示比现有药物的治疗有实质性的显著改善,例如在早期临床可以观察到显著的治疗效果。“BTD计划旨在促进和加快获得BTD认定药物的开发,并涉及FDA的资源承诺,以FDA提供早期和频繁的建议,召开多学科会议涉及高级管理人员,并在适当时候,加快对申请的审查。因此,现有证据能继续符合BTD的标准是非常重要的。
突破性治疗认定适用于一种药物(单独使用或与其他药物联合使用)及其正在研究的特定用途。为支持特定药物授予BTD的信息可能会随着时间的推移而改变。一些在早期开发中看起来似乎很有希望的药物,在后来的试验中,可能不会被证明是安全或有效的,或者在后期阶段没有观察到早期开发所暗示的治疗效果。因此,鉴于BTD计划的资源密集型性质,和FDA仅向符合法律标准的药物授予BTD的权力,FDA会定期评估认定产品是否继续符合BTD标准。如果后续数据不再支持该认定,FDA可撤销该认定。
三、撤销突破性治疗认定的一般考虑因素
早期临床数据,包括基于可靠的药效学终点的证据,通常用于支持 BTD。在授予 BTD 之后,信息可能会变得可用,以使证据不再表明药物满足 BTD 标准。例如,BTD 可能因以下原因而被撤销:
1、已批准使用另一种药物来治疗未满足的需求,这为授予BTD提供了依据。由于这种新疗法,BTD药物不再符合BTD标准,即对现有疗法有实质性改进的标准。注意,在加速批准下批准的另一种药物通常不会被认为足以导致撤销 BTD。
2、获认定的药物的新数据不再支持“初步的临床证据表明该药物可能对现有疗法有显着改善”的发现。
3、获认定的药物的申办者不再推动该药物作为BTD进行研发。
例如,如果在3 期试验明确显示获认定药物的作用未能达到其主要终点,或者受益程度较为适中,以至于试验未表明该药物可以证明比现有疗法有实质性改善。额外安全信息的出现改变了获认定产品的利益-风险评估,也可能支持撤销BTD 的决定。
在评估是否继续符合BTD标准时,对于在更大人群中进行的试验,FDA通常给予更大的权重,使用充分理解和广泛接受的、构建良好的临床终点,并结合某些设计特征(例如,随机化,盲法)。因此,可用证据的质量可能会影响FDA的决策。
在某些情况下,FDA可能会决定不撤销BTD的认定,即使是后续的结果似乎不支持BTD所依据的证据。例如,如果初始数据很有希望,而且后续研究的实施和设计存在重大问题,则在评估是否仍然满足 BTD 标准时后续研究可能会被赋予较少的权重。然而,如果从多个精心设计的研究中获得的证据反映了临床获益的不一致,那么评估BTD标准是否仍然满足可能会变得更具挑战性。例如,如果一项试验没有证明在正在研究的主要终点具有统计学意义的显著改善,但在次要临床终点上显示出有利趋势,那么该试验可能仍与 FDA 确定的“初步临床证据”来支持 BTD。在这种情况下,可能需要维持药物的 BTD,尤其是因很强的“初步临床证据”而获原始 BTD认定的。在这种情况下是否维持或撤销 BTD 的决定将取决于该药物开发计划的具体事实。
本指导文件提供了一般考虑事项,鼓励申办者与 FDA 讨论关于获BTD认定药物的不断变化的信息和情况的细节。
可点击下方“阅读原文”跳转至FDA官网进行查看
END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家以药品监管科学为特色的研发咨询公司,致力于为客户定制法规解决方案,减少和避免在注册申报时“少做、漏做、重做、多做”的风险。
在药品注册时,公司提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率。在研发过程中,公司提供第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外79个知名制药企业建立合作,取得了100多项IND/NDA/ANDA佳绩。
公司使命:为制药企业提供专家解决方案,提升药品全生命周期合规性
公司愿景:助力制药企业研发和生产,让老百姓吃上放心药







