2022年度药品审评数据浅析

2023年9月6日,国家药品监督管理局药审中心发布《2022年度药品审评报告》,科志康摘其一部份数据进行解读,希望能为国内药企业未来研发与上市的规划有所启发。
1、审评审批效率持续提速,加快药品上市进程。
2022年药审中心完成审评注册申请12368件,同比增长6.09%。其中,完成技术审评9301件,同比增长0.71%。受理无需技术审评直接审批的注册申请3067件,同比增加26.58%。
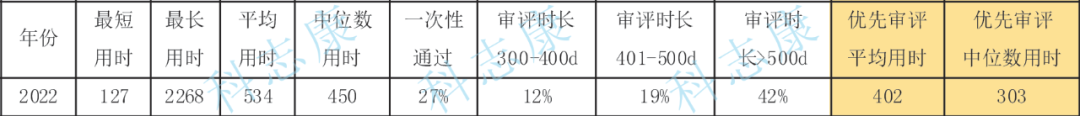
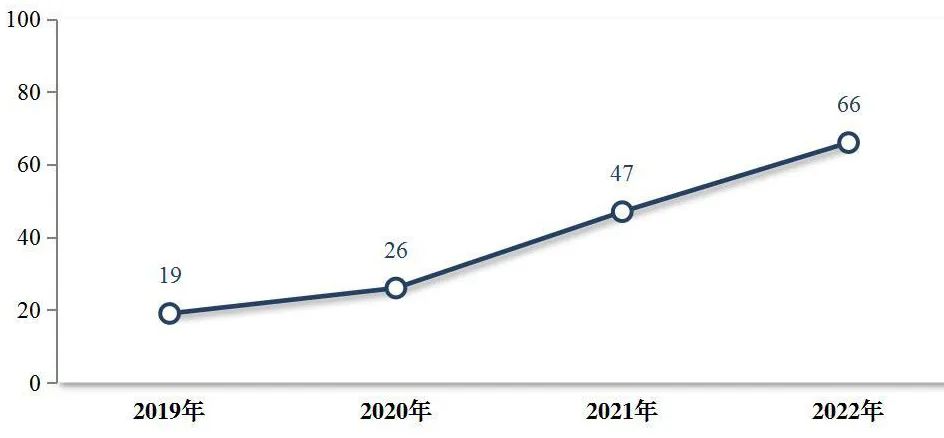
2015年9月高峰时,在审评和等待审评的注册申请将近22000件。自药审改革之后,药品审评效率显著提升,解决注册申请积压改革不断取得成效。三年疫情对研发创新的影响不容忽视,医药研发整体环境不利,但在2022年NMPA全力实现了各类注册申请按时限审评率达99.80%,创历史新高,且多个类别的按时限审结率取得历史性突破。随着国内审评环境不断完善,将持续推进医药行业发展。
2、注册申报数量增速放缓,化药仍小幅增长,生物制品有所下滑。
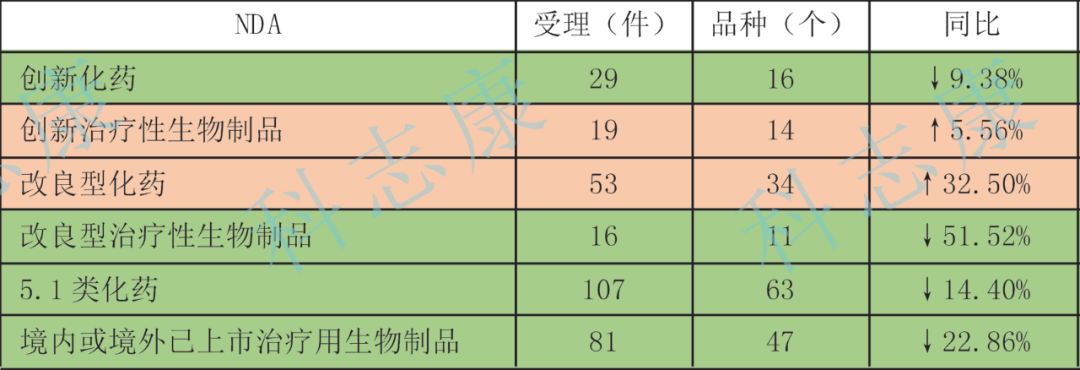
2022年已完成技术审评9301件中,化药注册申请7054件,占技术审评总量75.84%,同比增加3.92%;生物制品注册申请1820件,同比减少8.95%。
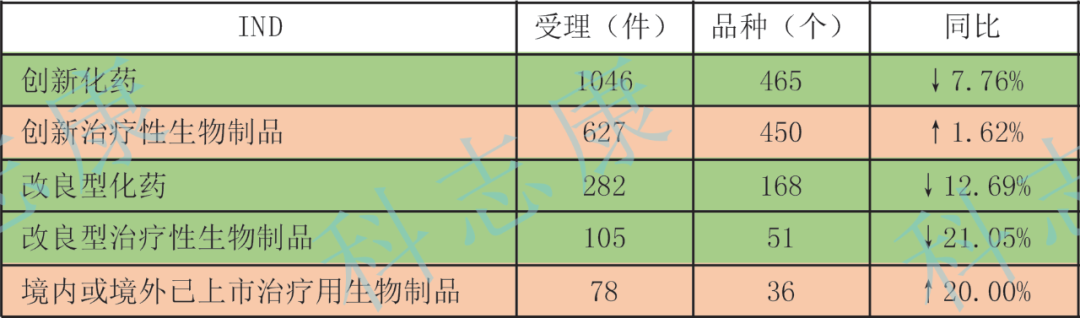
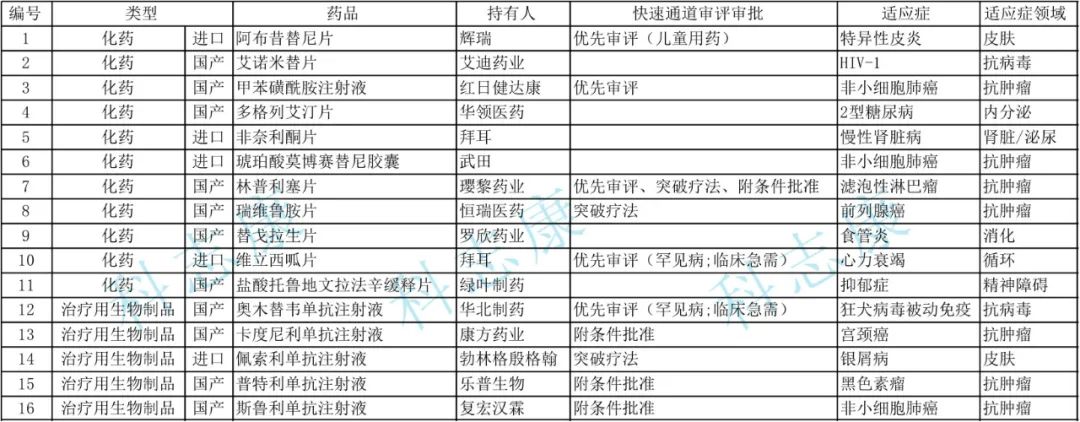
2022年共受理创新药注册申请1794件(1010个品种),同比减少4.88%。受理改良型新药注册申请489件(292个品种),同比减少10.44%。

END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家以药品监管科学为特色的研发咨询公司,致力于为客户定制法规解决方案,减少和避免在注册申报时“少做、漏做、重做、多做”的风险。
在药品注册时,公司提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率。在研发过程中,公司提供第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外79个知名制药企业建立合作,取得了100多项IND/NDA/ANDA佳绩。
公司使命:为制药企业提供专家解决方案,提升药品全生命周期合规性
公司愿景:助力制药企业研发和生产,让老百姓吃上放心药







