首款FDA上市TIL疗法Amtagvi的申报解读

2024年2月16日,FDA基于临床Ⅱ期试验加速批准了Iovance Biotherapeutics, Inc.的细胞疗法Amtagvi(Lifileucel),适用于治疗先前用PD-1阻断抗体治疗过的不可切除或转移性黑色素瘤成年患者。Amtagvi是首个上市的非嵌合抗原受体(CAR)T细胞免疫疗法,也是首个针对实体瘤的细胞疗法。Amtagvi获得孤儿药、快速通道、再生医学高级疗法指定和加速批准。
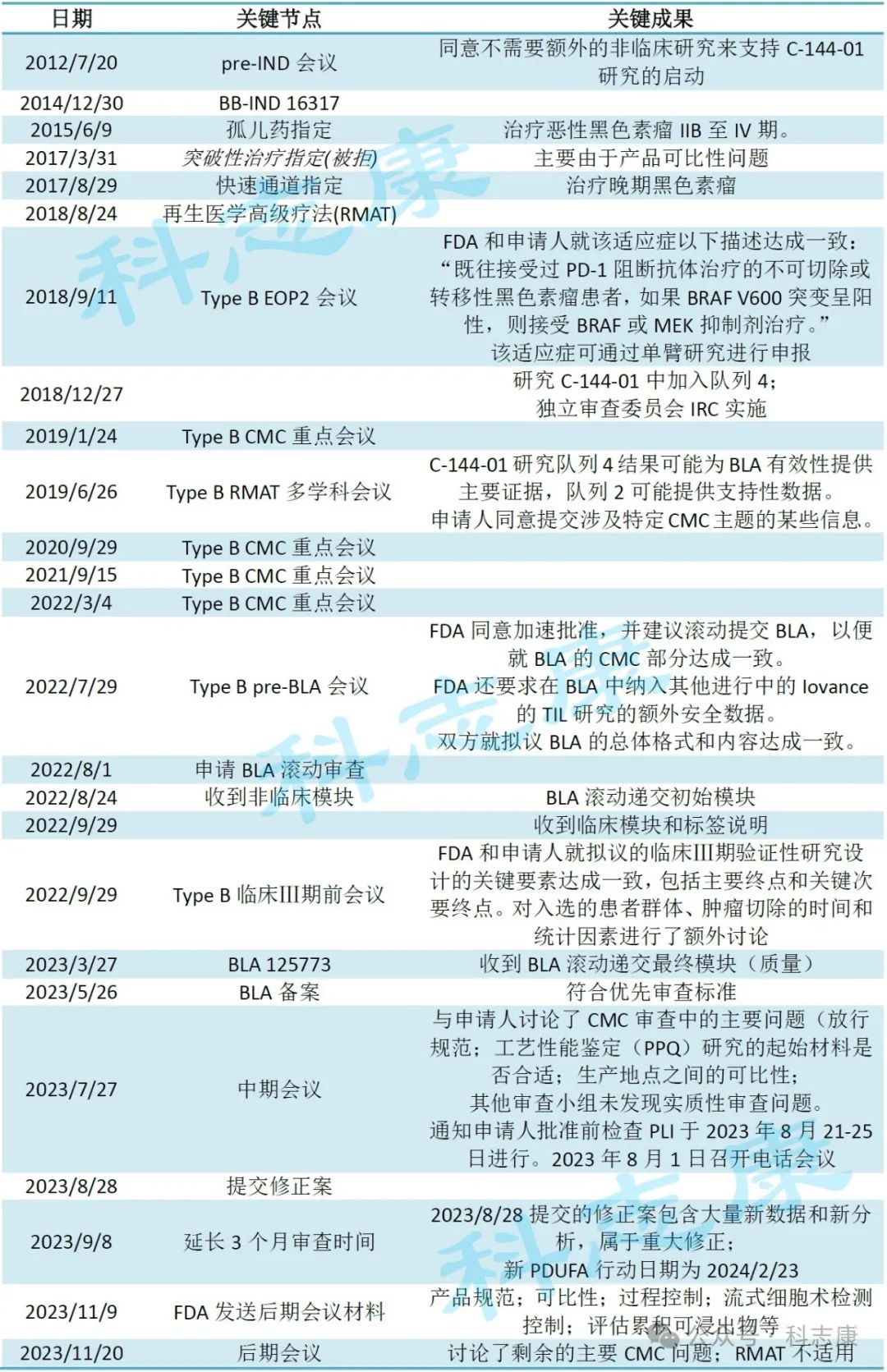
申报里程碑统计如下:
根据科志康大数据,基于中美欧日81个细胞和基因药物(CGT)130次上市审评显示,CGT的BLA审评耗时最短136天,最长1,680天,平均434天,中位数341天。
Amtagvi从召开pre-IND会议到正式获批IND用时2.4年,临床阶段(完成临床Ⅱ期)耗时8年,虽然其BLA获得优先审查并滚动递交,但因审评期间提交修正案补充大量新数据而延期3个月,最终用时325天获批,属CGT上市审评的中位水平。
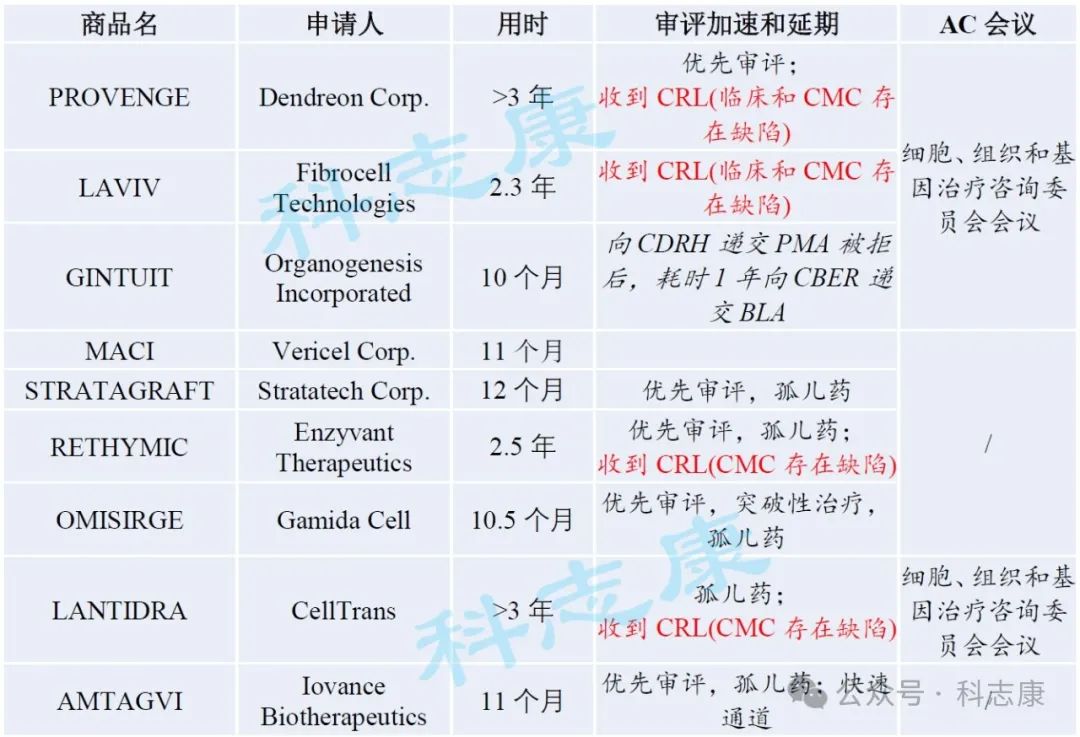
下表所列FDA批准的9款未经基因编辑细胞产品(包括Amtagvi)审评用时,可以发现延误上市的主要原因是收到CRL完全回复函,其中又以CMC存在缺陷最为普遍。查看Amtagvi申报里程碑可知,FDA与申请人在pre-BLA会议前召开了4次关于CMC的B类会议,而在申报BLA后的中期和后期会议中,讨论重点依然是CMC问题。
拓展阅读:
再生医学先进疗法(Regenerative Medicine Advanced Therapy,简称RMAT)
21st Century Cures Act(2016年12月13日)中第3033条阐述了获得RMAT的药物必须满足下列条件(同时),RMAT申请必须与IND同时提出,或作为已有IND的修订:
-
该药物是一种再生医学疗法,其定义为细胞疗法、治疗性组织工程产品、人类细胞和组织产品,或使用此类疗法或产品的任何组合产品,但《Public Health Service Act公共卫生服务法案》第361条和《美国联邦法规CFR》第21编第1271部分规定的除外;
-
该药物旨在治疗、改变、逆转或治愈严重或危及生命的疾病或病症;
-
初步临床证据表明,该药物有可能解决此类疾病或病症未满足的医疗需求。
FDA 把再生医学产品作为组合产品来管理,涉及再生医学产品的主要有三大审评中心:
-
药品评价研究中心(Center for Drug Evaluation and Research,CDER);
-
生物制品评价研究中心(Center for Biologic Evaluation and Research,CBER);
-
器械和放射卫生中心(Center for Devices and Radiological Health,CDRH)。

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家以药品监管科学为特色的研发咨询公司,致力于为客户定制法规解决方案,减少和避免在注册申报时“少做、漏做、重做、多做”的风险。
在药品注册时,公司提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率。在研发过程中,公司提供第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外79个知名制药企业建立合作,取得了100多项IND/NDA/ANDA佳绩。
公司使命:为制药企业提供专家解决方案,提升药品全生命周期合规性
公司愿景:助力制药企业研发和生产,让老百姓吃上放心药
电话:0757-82723283
网址:www.kezhikang.com
邮箱:info@kezhikang.com
地址:上海市浦东新区蔡伦路780号7层713室
佛山市禅城区祖庙街道祖庙路46号华辉大厦22层2204室









