ORR为90%!应世生物全球首创FAK抑制剂联合用药突破性治疗NSCLC



图片来源于网络

图片来源于应世生物公司官网
-
有效性:客观缓解率(ORR)达到90.3%,疾病控制率(DCR)达到96.8%。31例患者中共计28例达到部分缓解(PR),2例达到稳定疾病(SD)。
-
安全性:Ifebemtinib与Garsorasib联合应用的整体安全性与各自单药治疗一致。大多数与治疗相关的不良事件(AEs)为1级或2级,部分报告了3级AEs。
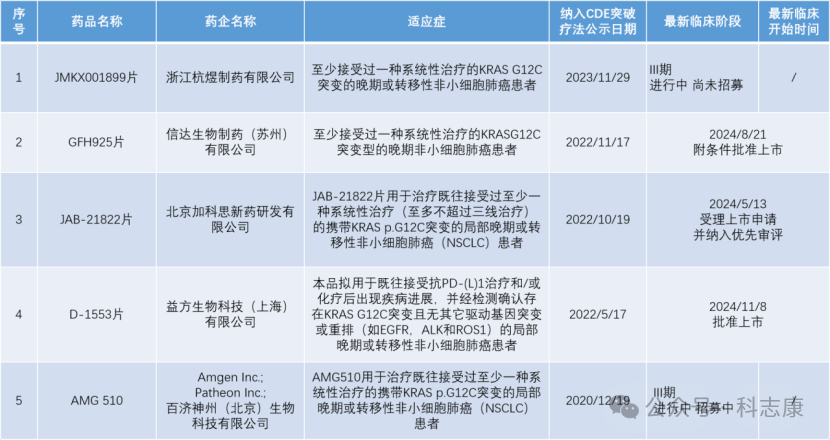



图片来源于网络

图片来源于应世生物公司官网
有效性:客观缓解率(ORR)达到90.3%,疾病控制率(DCR)达到96.8%。31例患者中共计28例达到部分缓解(PR),2例达到稳定疾病(SD)。
安全性:Ifebemtinib与Garsorasib联合应用的整体安全性与各自单药治疗一致。大多数与治疗相关的不良事件(AEs)为1级或2级,部分报告了3级AEs。
