赞荣A-1041肠溶胶囊纳入CDE突破疗法,治疗HER2乳腺癌

9月14日,CDE官网公示,苏州赞荣医药科技有限公司的ZN-A-1041肠溶胶囊已纳入突破性治疗品种,适应症为:ZN-A-1041联合卡培他滨和曲妥珠单抗用于既往接受过含曲妥珠单抗治疗进展的人表皮生长因子受体2 阳性(HER2 阳性)晚期脑转移乳腺癌患者。

在乳腺癌患者中有近30%-50%存在脑转移风险,且目前并无标准治疗药物上市,现有治疗方法仍局限于开颅手术和全脑放疗或立体定向放射治疗,不仅治疗副作用大,最终患者生存期也并不佳。
ZN-A-1041肠溶胶囊是一款靶向人表皮生长因子受体2(HER2)的同类最佳小分子口服选择性酪氨酸激酶抑制剂,同时具备高度血脑屏障通透性,可满足HER2+晚期乳腺癌脑转移治疗这一未获满足的医疗需求。
据公开消息称,ZN-A-1041具有以下设计特点: (1)跨越血脑屏障提供治疗效果; (2)对HER2选择性高,对野生型EGFR无抑制作用;(3)在联合治疗中使用足够安全;(4)在对大分子药物无反应或最小反应的患者中具有治疗活性。ZN-A-1041有望因其特点而具有的差异化在于: (1)高度血脑屏障通透性,从而提高中枢神经系统转移患者的临床疗效; (2)与现有的TKI抑制剂相比,不良反应减少; (3)良好的安全边际,适用于联合疗法。
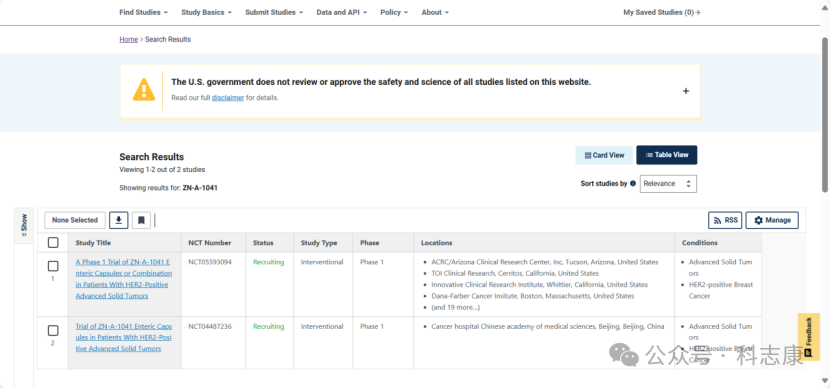
据clinicaltrials.gov,2020年第三季度,ZN-A-1041分别在这中国和美国启动了一期临床研究,目前状态仍在招募中。
值得一提的是,2023年5月,赞荣医药科技有限公司宣布与罗氏就收购口服小分子HER2抑制剂ZN-A-1041的全球权益达成协议。赞荣医药总部Zion Pharma Limited 成立于香港,苏州赞荣为其全资子公司和国内研发中心。近期,虽有业界消息报道苏州赞荣子公司上海赞荣在解散,但不影响赞荣医药正常运行,或许是为了优化资源配置,提高经营效率,才采取上述措施。苏州赞荣的ZN-A-1041获得CDE突破疗法认定已然是最好的证明,期望其其他管线可早日上市造福更多患者。
在2023年美国临床肿瘤学会(ASCO)年会上,研究人员公布了ZN-A-1041(又名:ZN-1041)的临床前和早期临床数据。
临床前数据表明,在脑转移瘤(BM)模型中,与图卡替尼相比,ZN-1041单药治疗表现出剂量依赖性和显著的抗肿瘤活性。此外,该药物可以与卡培他滨和曲妥珠单抗协同作用,在BM模型中显著提高颅内疗效,同时保持良好的耐受性。
ZN-A-1041-101(NCT04487236)是一项正在进行的I期、多中心、开放性研究。
临床数据显示,在TKI初治、HER2阳性的接受ZN-1041单药治疗的患者中,总体ORR和颅内ORR均为50%。最长治疗时间为15个月。此外,在19例至少进行了两次肿瘤评估的晚期脑转移乳腺癌患者中,ORR为78.9%,颅内ORR为73.7%,疾病控制率(DCR)为100%。
所有剂量水平均未观察到剂量限制性毒性或治疗相关SAE。ZN-1041的总体耐受性良好。3级以上(≥5%)不良反应包括:肝功能损害(8.7%)、头痛(8.7%)、高胆红素血症(5.7%)、ALT升高(5.7%)、AST升高(5.7%)、GGT升高(5.7%)和白细胞降低(5.7%)。
在TKI初治、HER2阳性的晚期脑转移乳腺癌患者中,观察到ZN-1041单药治疗或联合卡培他滨和曲妥珠单抗治疗的疗效和耐受性令人鼓舞。
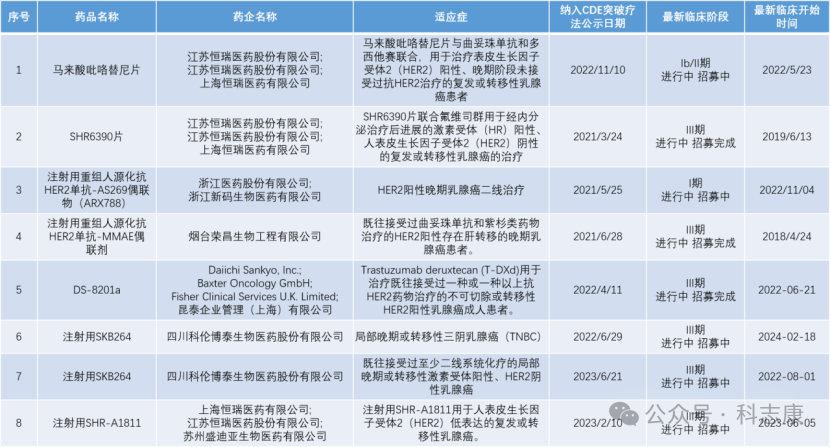
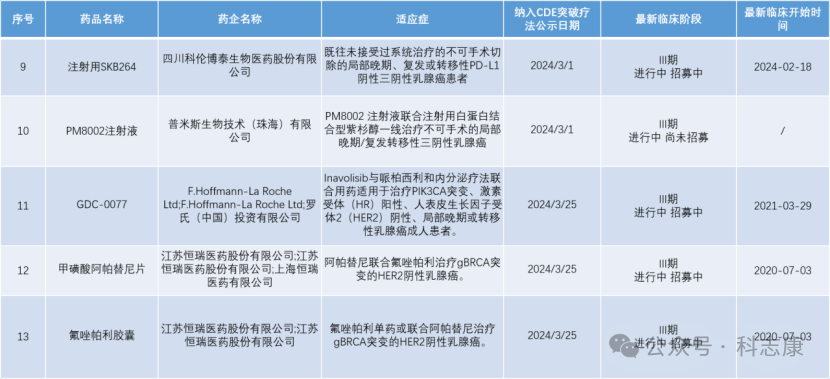
中国突破疗法程序从2020年7月1日开始实施,截至目前,CDE官网上公示突破性治疗品种名单已纳入267条。通过搜索科志康数据库,整理出同样被纳入CDE突破疗法的其他用于治疗“乳腺癌”的药物,如下图,除ZN-1041外,还有13项。ZN-1041用于治疗HER2+晚期乳腺癌脑转移,针对该细分适应症还尚少有突破疗效的药物,期待ZN-1041更突破的临床表现。
公司简介
网址:www.kezhikang.com
邮箱:info@kezhikang.com
地址:上海市浦东新区蔡伦路780号7层713室









