专家观点 | 历年纳入CDE“优先审评”程序药物深度解读

为加快具有临床价值的新药和临床急需仿制药的研发上市,2017年底,药监局出台《关于鼓励药品创新实行优先审评审批的意见》。2020年7月,国家食品药品监管总局发布并实施《药品上市许可优先审评审批工作程序(试行)》,并将2017年出台政策废止,并对纳入优先审评审批的药品范围进行了详细说明。
优先审评审批程序的调整,是在多年实践经验基础上的优化,一是适用范围更多地向具有明显临床价值、临床急需和临床优势的药物聚焦,致力于将更多的临床价值显著、临床急需的短缺药品、防治重大传染病、罕见病、儿童用药、纳入突破性治疗程序、符合附条件批准的药品等纳入优先审评程序;二是审评时限的加速,药品上市许可申请的审评时限一般为200个工作日,与完整的申报路径相比,优先审评审批程序的审评时限缩短至130个工作日,其中临床急需境外已上市罕见病用药优先审评审批程序的审评时限为70个工作日。
截至2021年11月15日,CDE网站上公示了共有1309件注册申请纳入“优先审评”审批程序。笔者分析了2016-2021年纳入优先审评审批程序的各类注册申请情况详见图1和图2。
优先审评品种纳入情况
从申请理由来看,自2020年7月实施最新规定以来,以“附条件批准”为申请理由的事项最多,共计56件;其次是药监局规定的其他优先审评情形,共计39件。
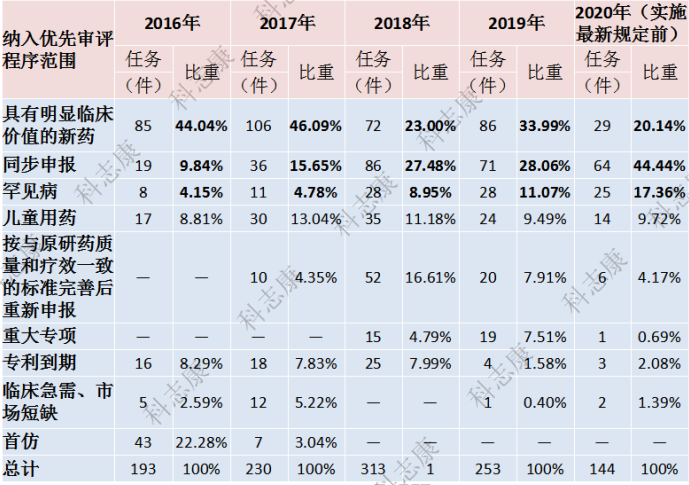
图1 :2016-2020年纳入优先审评审批程序的各类注册申请情况(以受理号统计)
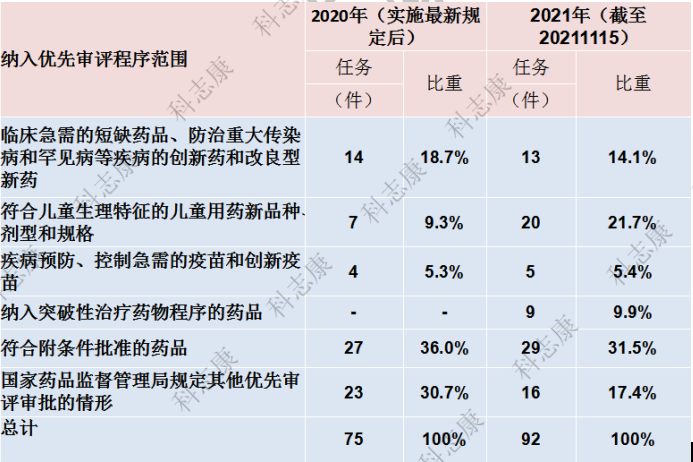
图2 :2020-2021年纳入优先审评审批程序的各类注册申请情况(以受理号统计)
优先审评品种完成情况
2020年有217件注册申请(按通用名计121个品种)通过优先审评程序建议批准上市(含已上市药品新增适应症),审评通过件数较2019年增长51.7%,如图3。
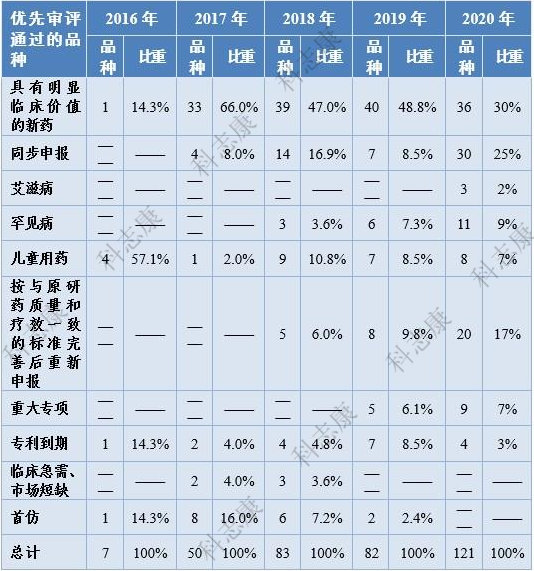
图3 :2016-2020年优先审评通过的品种情况(以品种数统计)
药品类型分析
从药品类型来看,1309件药品申请中,以化学药为主,占比为80%,其次为生物制品,为19%,中药最少,仅为1%,化药占据明显优势,如图4。
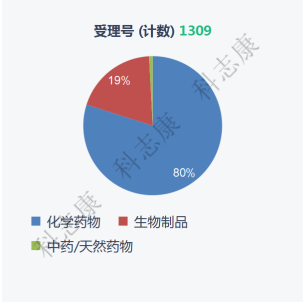
图4 :2016-2021年纳入优先审评审批程序的药品类型分析
药品申请类型分析
从药品申请类型来看,仿制药及进口药的占比都高于新药,仿制药占比39%(506件),进口药占比36%(474件),新药占比25%(349件),如图5。
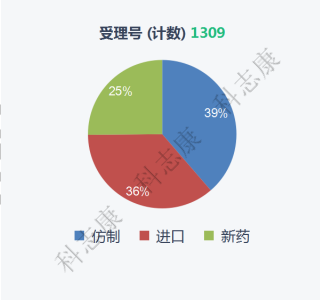
图5:2016-2021年纳入优先审评审批程序的药品申请类型分析
药品适应症分析
从适应症来看,纳入“优先审评”的药品适应症主要以抗肿瘤药物为主,占总体的25%,其次分别为神经系统疾病药物(16%)、抗感染药物(14%)、消化系统药物(9%)、心血管系统(9%),如图6。在抗肿瘤药物中,其适应症分布最多的是非小细胞肺癌,其次是淋巴瘤和乳腺癌。神经系统疾病药物中,其适应症分布最多的是精神分裂症,其次是癫痫和抑郁症。
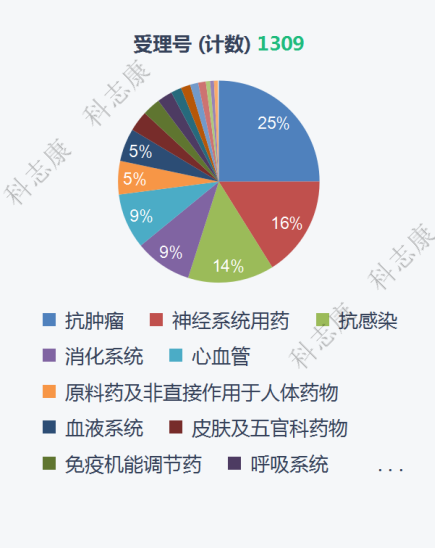
图6 :2016-2021年纳入优先审评审批程序的药品适应症类型分析
作用靶点分析
数量最多的前7位靶点分别为 EGFR、VEGF、VEGFR、DNA 等,且品种数量分别多达 67 件、47件、40件、54件,如图7。EGFR、VEGF和VEGFR这几个靶点的药物适应症领域集中在同一适应症领域(非小细胞肺癌)。DNA靶点其适应症主要为抗感染,包括对乙肝、HIV等的治疗。
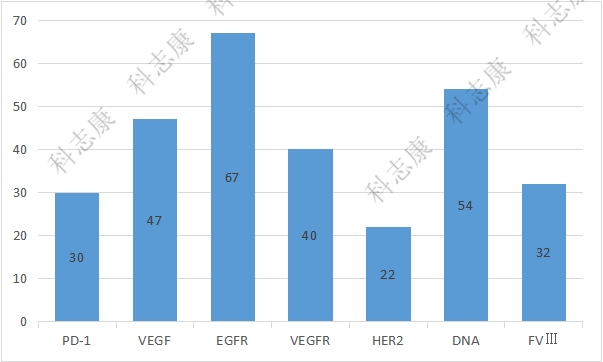
图7 :2016-2021年纳入优先审评审批程序的药品靶点类型分析
历史文章:
专家观点 | 历年CDE“优先审评”审批汇总分析
专家观点 | 来了!CDE“突破性疗法”审批深度剖析
最全“突破性疗法”CDE审批汇总
END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家专业的药品研发咨询公司,致力于为客户解决药品生命周期的难点和痛点,减少和避免注册时发生“少做、漏做、重做、多做”。
公司专注于药品法规战略咨询,提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率;在研发过程中提供法规咨询和第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外30多个知名制药企业建立合作,成功取得了40多项IND/NDA/ANDA佳绩。







