专家观点 | 近年FDA“优先审评”审批分析

FDA目前有4个加速计划项目:优先审查、加速批准、快速通道认定和突破性疗法认定。优先审评认定 (Priority Review Designation) 作为加快药物研发与审评通道之一,是FDA通过缩短审评时间以达到加快用于治疗严重疾病的创新药研发与获批目的的一种举措。
为明确包括“优先审评认定”等加速评审通道的定义,美国FDA在2013年6月出台了《行业指导原则:治疗严重疾病的化学及生物药加速申请指南》(Guidance for Industry Expedited Programs for Serious Conditions—Drugs and Biologics)。下面笔者在这里简要介绍一下它的申请条件、好处、近年审批分析等等。
“优先审评认定”的申请条件
1、治疗严重病症的药品申请(原始申请或疗效补充申请),证明存在安全性或有效性显著改善的潜力。显著改善可通过下述例子说明:
①病症治疗、预防或诊断有效性增加的证据。
②消除或确实减少治疗限制的药物反应。
③患者依从性明确增强,有望导致严重病症结果改善。
④对新亚群患者的安全性与有效性证据。
2、按照505Ac要求的儿科研究报告提出的标签说明变更补充申请。
3、已被认定作为合格的感染性疾病治疗的药品申请。
4、任何带有优先审评凭单的药品申请或补充申请。
“优先审评认定”的好处
优先审评需药企主动申请,FDA将在60日内给出答复。与标准的审评时间(10个月)相比, FDA对获得优先审评认定的药物,会在6个月内完成上市审批。
近年“优先审评认定”审批分析
笔者分析了FDA从2015年~2020年的“优先审评认定”数据,FDA共授予258件“优先审评认定”。这些药物涵盖小分子化学药、抗体、ADC等。从药品类型来看,化药占据明显优势,共197件,占76.4%。生物药共61件,占23.6%。(如图1)
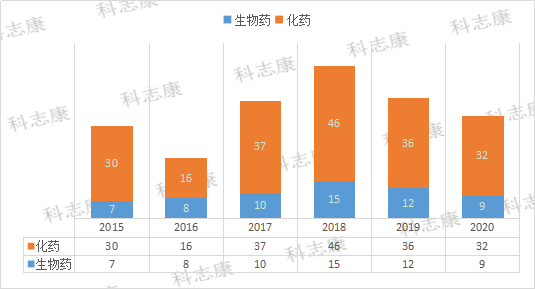
图1:2015年~2020年纳入FDA“优先审评”的药品类型分析
从适应症来看,纳入“优先审评”的药品适应症主要以抗肿瘤药物为主,占总体的31.4%,其次分别为抗感染药物(28.3%)、神经系统疾病药物(12.8%)、内分泌与代谢(8.1%),如图2。在抗肿瘤药物中,其适应症分布最多的是淋巴瘤,其次是白血病。抗感染药物中,其适应症分布最多的是HIV,其次是丙肝病毒感染。
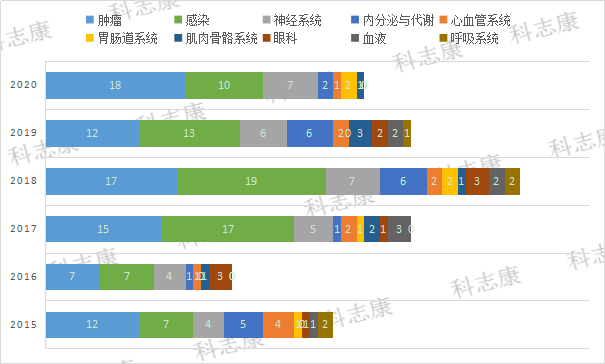
图2:2015年~2020年纳入FDA“优先审评”的适应症类型分析
中美“优先审评认定”对比及小结
去年7月,国家药品监督管理局药品审评中心(CDE)出台《药品上市许可优先审评药物审评工作程序》,对纳入优先审评审批程序的药品范围进行了详细说明。笔者简要对比了中美“优先审评认定”的重要内容,如下图3,内容大致相同,其目的都是为了加速开发及审查治疗严重、威胁生命的疾病的新药。以往鲜少有我国自主研发的新药获得FDA“优先审评”认定,但近两年已有百济神州的泽布替尼胶囊、万春医药的普那布林和基石药业的艾伏尼布获得中美“优先审评”双重认定。希望未来我国会有更多的自主研发药物获得更多的国际认可,唱出“中国之声”。
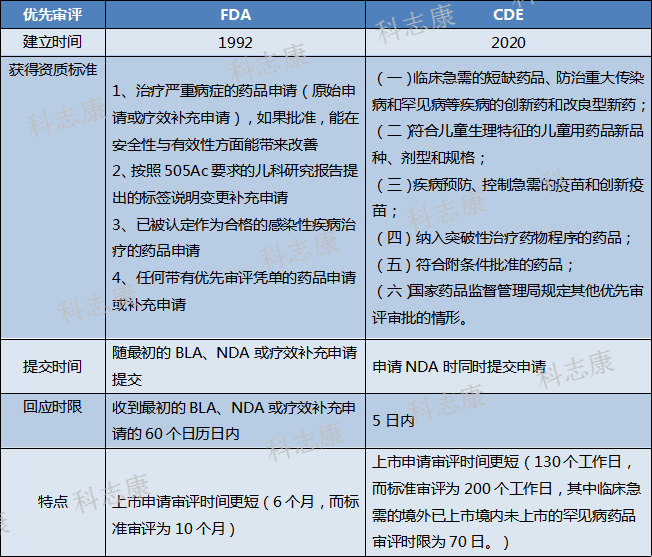
图3:中美“优先审评”重要内容对比分析
历史文章:
专家观点 | 历年FDA“突破性疗法”审批分析
END


扫码关注
科志康

关于科志康


上海科志康医药科技有限公司,成立于2016年,是一家以药品监管科学为特色的研发咨询公司,致力于为客户定制法规解决方案,减少和避免在注册申报时“少做、漏做、重做、多做”的风险。
在药品注册时,公司提供高品质的一站式注册申报和模拟现场检查服务,为客户提高药品注册成功率。在研发过程中,公司提供第三方项目管理服务,法规前置,过程管理,协助制药企业提升药品研发效率。
目前,公司已与国内外30多个知名制药企业建立合作,成功取得了40多项IND/NDA/ANDA佳绩。
公司使命:为制药企业提供专家解决方案,提升药品全生命周期合规性
公司愿景:助力制药企业研发和生产,让老百姓吃上放心药







