国内首款!重庆精准儿童白血病CAR-T纳入CDE优先审评

8月7日及6月27日,CDE官网公示,同意按优先审评范围“(四)纳入突破性治疗药物程序的药品”,将重庆精准生物的pCAR-19B细胞自体回输制剂(普基仑赛注射液)纳入优先审评程序,适应症为:3~21岁CD19阳性的复发或难治性B细胞急性淋巴细胞白血病患者。该产品是国内首款针对儿童白血病的CAR-T产品。

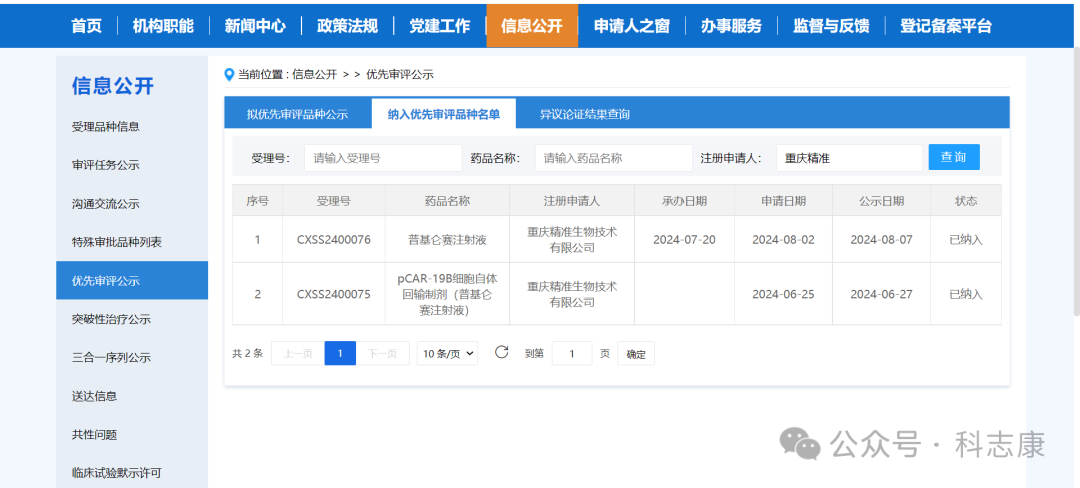
早在2023年11月,普基仑赛注射液被CDE纳入为突破性治疗品种。今年7月20日,CDE受理了其NDA申请,按优先审评品种130个工作日的审评审批时限,预计该产品将在明年1月获批上市,其有望成为中国在该治疗适应症首个上市的创新生物药。
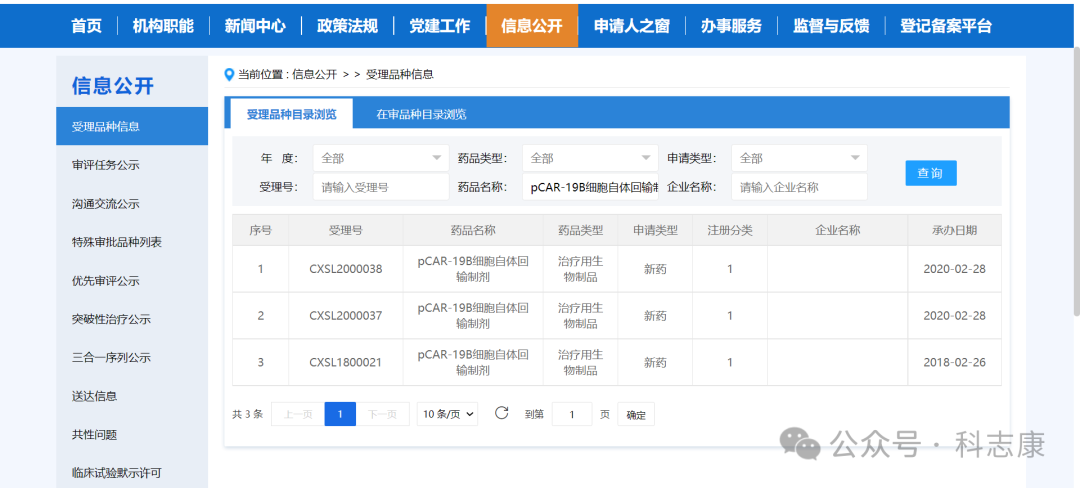
根据CDE官网,普基仑赛注射液首个IND于2018年2月26日被CDE受理,适应症为:
①3-21岁患有CD19阳性复发难治性急性淋巴细胞白血病患者。
后来,2020年2月28日被CDE同时受理2个IND申请,适应症分别为:
②适用于75岁及以下复发/难治性CD19阳性弥漫大B细胞淋巴瘤、滤泡性淋巴瘤和套细胞淋巴瘤患者
③适用于治疗22-70岁患有CD19阳性复发/难治性B细胞急性淋巴细胞白血病患者。
该3个IND均被CDE默示许可顺利获批。
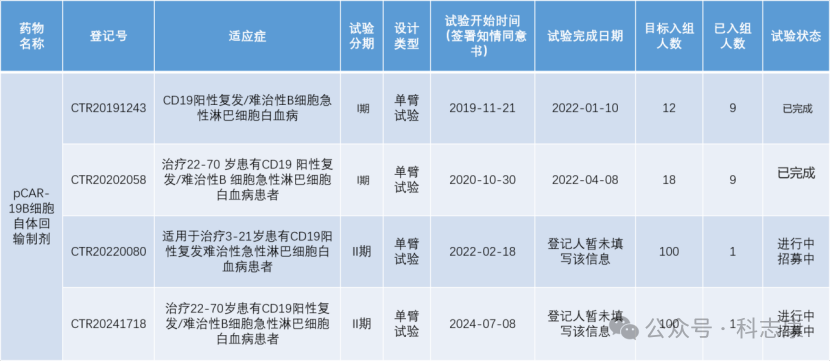
根据CDE药物临床试验登记与信息公示平台,普基仑赛注射液后来共开展了4个临床试验,如下表。
白血病是全球最为常见的恶性肿瘤之一,其发病总人数和每年新增人数均呈现上升趋势。其中,急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是儿童最常见的恶性肿瘤,其发病率约(3~5)/10万,也是导致儿童和青少年死亡的主要疾病之一,其中B-ALL约占ALL的80%左右。
据重庆精准生物官网介绍,普基仑赛注射液针对中国人群,对CAR(Chimeric antigen receptor,CAR)结构进行优化,同时采用了更为安全的基因转导载体系统,从而具有更好的有效性和安全性。
2019年开展的Ⅰ期临床试验数据显示,入组的9例患者均获得完全缓解(CR),总体缓解率达100%,且首次达到完全缓解(CR)的患者微小残留病变(MRD)也均为阴性;无剂量限制性毒性(DLT)和治疗相关死亡事件发生,总体安全性和耐受性良好。
中国优先审评程序从2017年开始实施,截至目前,CDE官网上公示被授予优先审评资格已纳入1581件,据科志康统计,目前在该公示名单中共约有2.3%(37件)的产品用于治疗白血病,例如赫基仑赛注射液、注射用倍林妥莫双抗、甲磺酸伊马替尼片等,较多用于成人患者。
其中有以下是治疗急性淋巴细胞白血病(非限定成年患者)。
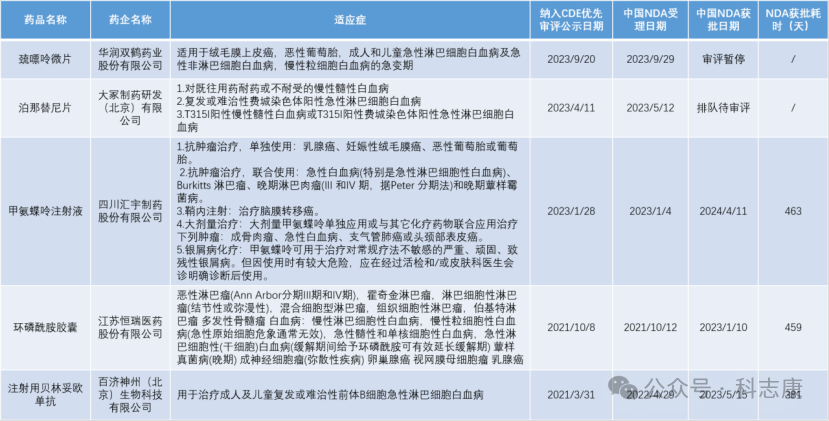
根据科志康之前统计的2018-2023年的创新药NDA审评用时,对比发现,甲氨蝶呤注射液、环磷酰胺胶囊纳入优先审评后的审评耗时为463、459天,大大缩短了NDA审评时间,比普通审评平均用时缩短了至少100天。注射用贝林妥欧单抗纳入优先审评后的审评耗时为381天,比普通审评平均用时缩短了至少200天。可见,利用优先审评通道,药监部门提高审评速率,审评时限缩短,的确为药品的加速上市起到关键作用。
网址:www.kezhikang.com
邮箱:info@kezhikang.com
地址:上海市浦东新区蔡伦路780号7层713室









